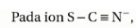K I M I A (2017)
36. Untuk reaksi pembakaran metana (CH4) seperti
berikut (belum setara):
CH4 (g) + O2 (g) → CO2 (g) + H2O (g)
Diketahui ∆H0
f CH4 (g), CO2 (g), dan H2O (g)
berturut-turut adalah -74,9 kJ/mol, - 393,5
kJ/mol, dan 241,8 kJ/mol. ∆H pembakaran 32
g metana (Mr = 16) sebesar ….
A. – 1604,4 kJ
B. – 802,2 kJ
C. – 401,1 kJ
D. + 502,2 kJ
E. + 1604,4 kJ
37. Reaksi dekomposisi berikut terjadi di dalam air
bag mobil
2NaN3 (s) → 3N2 (g) + 2 Na (s) ∆H = - 45,3 kJ
Panas pembentukan ∆H0
f untuk NaN3 adalah
….
A. – 45,3 kJ
B. – 21,8 kJ
C. + 21,8 kJ
D. + 43,5 kJ
E. + 10,9 kJ
38. Diketahui data percobaan penentukan orde
reaksi sebagai berikut.
No. [X] M [Y] M Waktu reaksi
(menit)
1 0,1 0,1 16
2 0,1 0,2 8
3 0,4 0,4 1
Waktu reaksi pada saat konsentrasi [X] dan
[Y] masing-masing 0,2 M adalah ….
A. 2 menit
B. 3 menit
C. 4 menit
D. 5 menit
E. 6 menit
39. Pada suhu tertentu dalam ruang tertutup yang
bertekanan 6,25 atm terdapat dalam keadaan
setimbang 0,5 mol gas SO2, 0,5 mol gas SO3
dan 0,25 mol gas O2 dengan reaksi:
2SO3 (g) ⇌ 2SO2 (g) + O2 (g)
Harga Kp pada suhu tersebut adalah ….
A. 11,50 atm
B. 6,25 atm
C. 2,50 atm
D. 1,25 atm
E. 0,625 atm
40. Diketahui Ksp Cd(OH)2 adalah 25 x 10-14. Jika
pH suatu larutan garam CdCl2 0,00025 M
dinaikkan dengan menambahkan padatan NaOH,
maka endapan Cd(OH)2 akan terbentuk setelah
pH larutan lebih dari ….
A. 9
B. 10
C. 11
D. 12
E. 13
41. Atom karbon yang memiliki hibrida sp3
terdapat pada molekul ….
A. Benzena, C6H6
B. Etana, C2H6
C. Etena, C2H4
D. Etuna, C2H2
E. Fenol, C6H6O
42. Dalam reaksi fisi di bawah ini, produk yang
belum diketahui adalah ….
43. Atom A mempunyai 11 proton dan 12 neutron,
sedangkan atom B mempunyai massa atom 16
dan mengandung 8 neutron. Jika A dan B
berikatan, molekul yang terbentuk memiliki
massa molekul sebesar ….
A. 62
B. 55
C. 49
D. 47
E. 31
44. Sukrosa (C12H22O11) dapat dioksidasi dengan
asam sulfat pekat, (H2SO4) menghasilkan
karbon (C) dan uap air (H2O). jika 342 g
sukrosa direaksikan dengan asam sulfat pekat
berlebih maka volume uap air yang dihasilkan
pada keadaan STP adalah ….
(diketahui Ar C = 12, H = 1, O = 16)
A. 61,6 L
B. 132,2 L
C. 184,8 L
D. 246,4 L
E. 308 L
45. Jika dalam reaksi:
2HCl + n → nCl2 + H2
Digunakan 25,0 mL larutan HCl 4,0 M untuk
menghasilkan gas H2, maka logam Zn (Ar =
65) yang diperlukan untuk bereaksi secara
sempurna adalah ….
A. 1,65 g
B. 3,3 g
C. 6,5 g
D. 13,0 g
E. 25,0 g
46. Batu kapur sebanyak 25 gram yang mengandung
CaCO3 (Mr = 100) dan zat pengotor dilarutkan
dalam air panas hingga sempurna menghasilkan
Ca(OH)2 (aq), H2O (l), dan CO2 (g). Jika larutan
ini dapat dinetralkan dengan 200 mL larutan HCl
2M, maka persentase massa CaCO3 dalam
batuan adalah ….
A. 40%
B. 50%
C. 60%
D. 80%
E. 90%
47. Pada elektrolisis leburan NaCl, gas H2 akan
terbentuk di katoda
SEBAB
Ion Na+
sangat sulit tereduksi menjadi logam
Na
48. Laju reaksi berbanding lurus dengan suhu reaksi
SEBAB
Semakin tinggi suhu reaksi, maka energi
kinetik molekul semakin besar sehingga dapat
menurunkan energi aktivasi.
49. Pada reaksi HNO3 + H2SO4 → NO2
+
+ HSO4
-
+ H2O
asam nitrat berperan sebagai basa
SEBAB
Pada reaksi tersebut asam nitrat menerima
proton dari asam sulfat
50. Hukum kesetimbangan untuk reaksi
penguraian PCl5 menjadi PCl3 dan Cl2 adalah
K =
PCl5 (g) ⇌ PCl3 (g) + Cl2 (g)
SEBAB
PCl5 dan PCl3 memiliki geometri masing-masing
trigonal bipiramida dan trigonal piramida
51. Jika ke dalam 100 mL NH3(aq) 0,2 M
ditambahkan 100 mL larutan asam sulfat 0,1
M, maka pernyataan yang benar berikut adalah
…. (Kb NH3(aq) = 2 x 10-5
)
(1) pH larutan sebelum ditambah asam
adalah 3 – log 2
(2) campuran tersebut adalah larutan
penyangga
(3) konsentrasi garam yang terjadi adalah 0,2
M
(4) campuran tersebut mempunyai pH
kurang dari 7
52. Di antara senyawa – senyawa alkohol berikut
yang dapat dioksidasi menghasilkan keton
(alkanon) adalah ….
(1) 2-metil-1-butanol
(2) 2,2-dimetil-1-propanol
(3) 3-metil-1-butanol
(4) Sikloheksanol
53. Jika atom dari unsur Y dapat membentuk ion
Y
2+, maka pernyataan yang benar untuk unsur
adalah ….
(1) Dapat membentuk oksida logam
(2) Termasuk logam golongan IIA atau
logam transisi
(3) Dapat membentuk ikatan ionik
(4) Mudah larut dalam air
54. Jika 20 asam amino alanin (H3C-CH(NH2)-
CO2H) berpolimerisasi kondensasi membentuk
protein, maka pernyataan berikut yang benar
adalah ….
(Mr alanin = 90, H2O = 18)
(1) Akan dihasilkan 20 molekul air
(2) Alanin bersifat optis aktif
(3) Akan dihasilkan protein dengan berat
molekul 1780
(4) Terbentuk protein yang dapat diuji
dengan reagen Biuret
55. Pada baterai mobil, arus listrik dihasilkan dari
reaksi redoks. Pernyataan yang benar
mengenai baterai mobil adalah ….
(1) PbO2 bertindak sebagai katoda
(2) Besarnya arus bergantung pada luas area
elektroda
(3) PbO bertindak sebagai anoda
(4) H2SO4 berfungsi sebagai elektroliT